2017年8月21日,金沙集团1862cc阎锡蕴课题组与广东医科大学附属医院张晶晶课题组合作在PNAS杂志以长文形式(PNAS Plus)在线发表题为“CD146 coordinates brain endothelial cell–pericyte communication for blood–brain barrier development”的研究论文,揭示了CD146 在血脑屏障 (blood-brain barrier, BBB) 发育中协同周细胞与血管内皮细胞的作用机制。
BBB对维持中枢神经系统的稳态至关重要,其发育是一个由血管内皮细胞、周细胞等紧密协同的渐进过程,包括BBB诱导形成和屏障功能成熟两个阶段。尽管目前对于内皮细胞和周细胞在BBB发育中各自的功能已有报道,但二者的协同调控机制,一直是本领域的未解之谜。
该研究首次报道新生血管标志分子CD146在BBB发育过程中动态调控内皮和周细胞相互作用并促进BBB形成。在此过程中,随着BBB发育过程的演进,CD146的表达呈动态变化,在发育早期,CD146在内皮细胞中表达, 而当周细胞出现后,CD146在内皮细胞上的表达被抑制,转而在周细胞上表达。随后深入的机制研究表明,CD146这种动态表达模式,是由其协调内皮细胞和周细胞的相互作用从而在时空上调控BBB发育的功能决定的。在BBB发育早期,内皮细胞中CD146调控紧密连接蛋白主要成员claudin-5的表达,诱导BBB开始形成;当周细胞出现时,周细胞表达的CD146作为共受体参与PDGF-B/PDGFRβ介导的信号通路,促进内皮细胞对周细胞的招募,形成具有屏障功能的BBB。周细胞包裹内皮细胞后,分泌TGF-β1下调内皮细胞中CD146的表达,由此抑制CD146介导的免疫细胞浸润到脑实质的功能,促进中枢的免疫稳态,使屏障功能达到进一步的成熟。
该研究成果不仅揭示了BBB发育中内皮和周细胞的有序协同作用机制,同时也为CD146在中枢性疾病中的作用机理提供了新证据。前期课题组发表在Scientific Report 杂志的研究发现,在多发性硬化疾病中,CD146在脑内皮细胞高表达,通过调控内皮细胞与免疫细胞粘附,促进免疫细胞浸润到中枢神经系统来发挥免疫监视功能。该研究将BBB成熟期内皮细胞低表达CD146促进免疫稳态和前期发现的病理期内皮细胞高表达CD146促进免疫反应相联系,进一步为靶向CD146治疗中枢炎症疾病提供了新的理论基础。
阎锡蕴课题组长期致力于肿瘤血管新靶点CD146在肿瘤血管生成、生长及转移中的作用机制研究;广东医科大学附属医院张晶晶课题组系统地利用小鼠、斑马鱼等模式动物开展血脑屏障的发育、功能调节以及疾病条件下血脑屏障的损伤和修复机制等的研究。
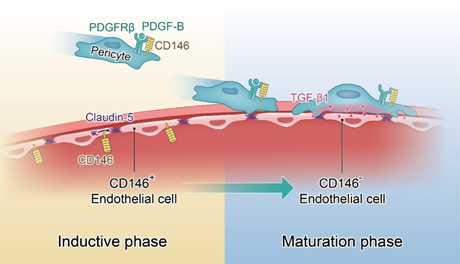
图示:CD146动态调控内皮和周细胞相互作用促进血脑屏障形成
 附件下载:
附件下载: