2020年2月29日(北京时间),国际蛋白质组学领域权威期刊《Molecular & Cellular Proteomics》在线发表了由金沙集团1862cc杨福全研究员团队和金沙集团1862cc数学与系统科学研究院付岩副研究员团队在人血清N-链接糖基化蛋白质组学研究中所取得的重要进展“Large-scale Identification of N-linked Intact Glycopeptides in Human Serum using HILIC Enrichment and Spectral Library Search”。
糖基化是最重要和最普遍的蛋白质翻译后修饰之一。蛋白质糖基化在细胞中起着至关重要的作用,包括蛋白质折叠、转运和稳定性的调控,以及细胞生长、细胞?细胞通讯、细胞-基质相互作用、病毒复制和免疫应答等各种生物学过程的调节。异常的蛋白质糖基化修饰通常与许多疾病的病理进展有关,包括癌症、神经退行性疾病、肺部疾病、血液疾病和遗传病等。大多数糖蛋白质是潜在的药物作用靶标和疾病诊断生物标志物。蛋白质糖基化修饰主要包括N-链接糖基化和O-链接糖基化,其中N-链接糖基化约占70%。N-链接糖蛋白分布广泛,从各种细胞表面到血清、脑脊液和尿液等不同的体液等。分泌在体液中的糖蛋白被认为是个体健康状态一个特征窗口。这些特征使糖蛋白成为临床和生物学研究中一类重要目标。蛋白质糖基化异常复杂,存在宏观不均一性和和微观不均一性,因此使得糖蛋白组学研究尤其是N-链接完整糖肽的鉴定具有挑战性。血清蛋白丰度的动态范围较宽,糖基化蛋白质丰度低,完整的人血清N-糖数据库的缺乏,加上存在非特异性酶切而产生不同的蛋白质变体,使得人血清N-糖蛋白质组学研究更具挑战性。
该合作研究首先通过乙腈沉淀将血清蛋白分离为低丰度和高丰度的蛋白质两部分。分别酶解消化后,通过亲水相互作用色谱(HILIC)高效富集N-链接完整糖肽,部分糖肽用N-糖苷酶F(PNGase F)处理生成N-链接去糖肽。用LC-MS/MS分别分析N-链接去糖肽和完整糖肽。对于N-链接去糖肽数据集,采用常规序列库搜索进行鉴定,考虑四种N-链接糖基化序列模体(NXS/T/C/V,X≠P)来识别N-链接去糖肽段。利用所鉴定的N-链接去糖肽的二级质谱构建了加入含有五糖核心的系列Y离子(Y1,Y2…Y5)的N-链接去糖肽段二级质谱谱库。同时还构建了包含739个N-糖质量的数据库。N-链接完整糖肽的鉴定采用基于谱库搜索的策略,利用pMatchGlyco软件、N-链接去糖肽段谱库和N-糖质量数据库对N-链接完整糖肽数据集进行系统地分析。相对于序列库式搜索方法,谱库搜索方法具有更高的灵敏度和更快的搜索速度。此外,通过母离子质量优化以及考虑半特异酶切和高丰度化学修饰,进一步提高鉴定灵敏度。最终共鉴定了526个N-链接糖蛋白、1036个N-链接糖基化位点、22677个N-链接完整糖肽和738个N-糖类型,使得人血清蛋白N-链接糖基化修饰分析和N-糖蛋白组学研究达到了新的高度。以血清中典型的糖蛋白转铁蛋白的N-链接糖基化修饰分析结果为例,本研究从血清中的转铁蛋白中共鉴定到4个N-链接糖基化位点(N432, N523, N630和N637),各位点所鉴定N-糖链类型数目分别为371、 2、364和34。从市售的人血清转铁蛋白对照品中共鉴定到5个糖基化位点(N432,N491,N523,N630和N637),各位点所鉴定N-糖链类型数目分别为559, 5, 6, 547 和 117个。结果充分展示了糖基化修饰的微观不均一性。
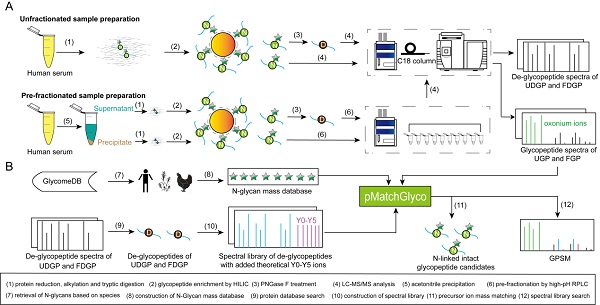
图1.人血清N-链接完整糖肽鉴定策略与实验流程。
A:血清蛋白质样品和N-链接完整糖肽样品经过预分与不预分的处理过程;
B:N-链接完整糖肽鉴定的数据分析流程。
该工作是杨福全团队和付岩团队继合作开发糖基化修饰分析软件pMatchGlyco(https://www.ncbi.nlm.nih.gov/pubmed/30186849)之后的再度合作。
文章链接:https://www.mcponline.org/content/19/4/672
(供稿:杨福全研究组)
 附件下载:
附件下载: