生物大分子自组装成超分子结构后会产生重要功能,这与生命系统中的生理或病理状态息息相关。蛋白质和多肽组装成淀粉样纤维的行为已被认为与神经退行性疾病密切联系。淀粉样蛋白组装体具有相似的交叉β结构,其中β链片段垂直于长纤维排列。这种类型的组装是由主链氢键和侧链相互作用(例如π-π堆积、疏水相互作用和范德华)驱动的。β-淀粉样蛋白(Aβ)可以交叉β模式自组装成低聚物或纤维丝,从而损伤神经元和突触,并导致神经退行性疾病,如老年痴呆(AD)和帕金森病(PD)。与毒性较小的Aβ1-40相比,Aβ1-42更疏水,更容易聚集,被认为是AD发展的更重要因素。然而,Aβ1-42淀粉样蛋白组装在AD发病机制中的基本作用和意义尚未完全阐明。对Aβ1-42组装的研究有助于我们理解AD的发病机制,为诊断和干预提供潜在的靶点。例如,Aβ1-42可以通过和铜等金属离子共聚集,产生reactive oxygen species(ROS),在AD中造成氧化应激。因此,靶向Aβ1-42的自组装过程是一种有前景的治疗策略。
Aβ1-42的19,20号位氨基酸FF作为其组装核心基序,被广泛研究并被报道可形成β结构的超分子纳米结构,因此受到广泛关注。研究FF的自组装行为可以更好地揭示Aβ1-42的聚集发生过程。但FF与Aβ1-42的组装行为不完全相同,因为Aβ1-42中的其他氨基酸也会影响自组装。氨基酸残基,如芳香基、氨基或羧基,可以通过π-π堆积力和其他相互作用(如氢键和范德华力)驱动并影响FF的组装。在20种天然氨基酸中,组氨酸(His)在蛋白质的相互作用中发挥多种作用,并可作为参与酶催化的关键残基。His作为中性形式的芳香π(His)或质子化形式的阳离子(His+)可以与其他芳香氨基酸进行π-π堆叠及H-π作用。His还可以与金属配合调节酶的催化作用。例如,His170与血红素中心的铁配位,以调节辣根过氧化物酶的催化作用。His可以用作修饰或自组装成人工酶的关键单元,以模拟过氧化物酶(POD)样或过氧化氢酶(CAT)样活性。因此,His不仅可以调节FF自组装的纳米结构,还可赋予组装体特定的生物活性。Aβ1-42的6,13,14号位均为His,这为其和19,20FF的相互作用提供了可能。同时,FF和His的相互作用也可能会构成酶的催化活性位点,使得Aβ1-42具有纳米酶的活性从而造成氧化损伤。
在该项目中,研究人员证明His在Fmoc-F-F二肽的组装中起关键作用,并调控其催化行为,从而为Aβ1-42催化和AD发病机制之间提供了联系。与大多数FF组装是在有机溶剂(如二甲基亚砜(DMSO)、六氟异丙醇(HFIP))中进行的研究不同,该项目证明了氨基酸,特别是His水溶液的存在下,可以将Fmoc-F-F从纳米棒转变成纤维丝(图1)。
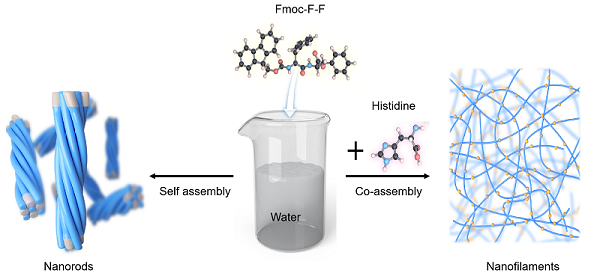
图1 His调控Fmoc-F-F二肽组装示意图
此外,Fmoc-F-F(His)纤维丝表现出过氧化物酶(POD)活性,表明His对催化做出了重要贡献。研究发现Aβ1-42纤维丝也表现出POD活性(图2a),其中His可能在催化中发挥作用,因为Aβ1-42(6His→Ala)POD活性相比于Aβ1-42降低(图2b)。Alphafold2预测结果表明,His/FF的活性位点可能来源于分子间的组装,这说明Aβ1-42纤维丝可以具有多个活性位点。这种特征不同于通常在蛋白质结构内具有单一活性中心的传统酶。此外,组装的Aβ1-42纤维丝很难被降解,并且可以长期稳定存在,因此很容易获得持久的催化活性。因此,与传统的天然酶不同,Aβ1-42纤维丝可能是一种天然纳米酶,它提供了另一种基于多肽组装的催化模式。
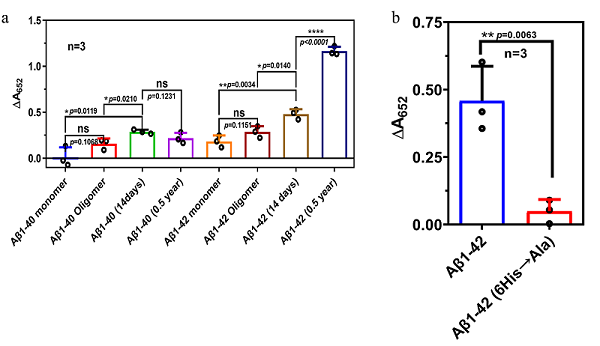
图2 Aβ1-42催化活性。a Aβ的POD活性。b Aβ1-42突变体的POD活性。
研究人员推测Aβ1-42纤维丝可以作为一种具有POD活性的天然纳米酶,在 AD发病机制中可能存在一定作用(图3)。His残基有可能作为控制AD中Aβ1-42沉积和降低神经毒性的靶点。除了AD中的Aβ1-42纤维丝外,在许多疾病中还发现了大量淀粉样蛋白聚集体,如II型糖尿病中的胰岛淀粉样多肽、甲状腺癌中的人降钙素、帕金森病中的α-突触核蛋白、肌萎缩侧索硬化症(ALS)中的抗氧化酶SOD1。这些蛋白聚集体也可能具有类酶活性,从而通过催化在疾病的发生发展中扮演重要作用。该研究为天然纳米酶的发现提供新的见解,以帮助我们发现蛋白质聚集体在相关疾病中的作用。
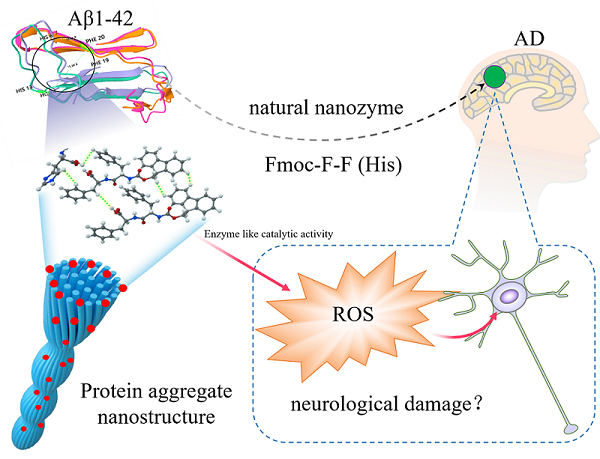
图3 Aβ1-42天然纳米酶示意图
上述研究成果于2023年9月19日在线发表在Nature Communications杂志,标题为Histidine modulates amyloid-like assembly of peptide nanomaterials and confers enzyme-like activity。金沙集团1862cc高利增研究员和吉林大学王丽萍教授为共同通讯作者,金沙集团1862cc和吉林大学联合培养博士研究生袁野为本文第一作者,金沙集团1862cc陈雷副研究员协助完成相关理论计算分析工作,金沙集团1862cc章新政课题组的孔令斐博士协助完成了冷冻电镜成像与分析工作。该研究得到了国家重点研发计划、国家自然科学基金创新群体和重点等项目的资助。
文章链接:https://www.nature.com/articles/s41467-023-41591-1
(供稿:高利增研究组)
 附件下载:
附件下载: