2011年2月6日,国际著名期刊Nature Structural & Molecular Biology在线发表了金沙集团1862cc生物物理所常文瑞院士课题组关于高等植物光合膜蛋白——菠菜次要捕光复合物CP29的2.8 ?分辨率晶体结构(Structural insights into energy regulation of light-harvesting complex CP29 from spinach)。该项工作是继2004年常文瑞院士课题组解析了菠菜主要捕光复合物LHCII晶体结构之后的又一重要突破,也是国际上首个高等植物次要捕光复合物的晶体结构。该研究工作在晶体结构的基础上深入分析讨论了CP29的捕光、能量传递和光保护等功能。
光系统II次要捕光复合物CP29位于主要捕光复合物LHCII与核心复合物之间的界面上,是维持PSII-LHCII超大复合物所必需的。CP29除了承担捕获太阳能并将能量高效传递到反应中心外,还在LHCII与反应中心之间的能量传递中起到桥梁作用。此外,CP29还参与强高光照条件下植物自身的光保护机制(如以热的形式将过多的激发能耗散掉,即非光化学淬灭NPQ)。由于CP29在光系统II中的含量较低并且结合多种色素分子,存在见光不稳定性,因而获得足够量并且稳定、均一可用于晶体生长的蛋白样品十分不易。而高等植物光合膜蛋白结晶是国际公认的难题,即便获得晶体也往往因为衍射能力很差而无法用于结构解析,因此,多年来一直没有CP29的晶体结构信息。
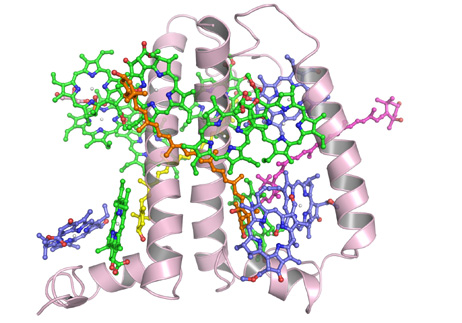
经过5年多的潜心研究和不懈努力,常文瑞院士课题组最终取得了突破,解析了来源于高等植物菠菜的CP29晶体结构。晶体结构显示,CP29脱辅基蛋白具有三段跨膜螺旋和两段位于类囊体腔侧的两亲性螺旋,每个单体结合有13个叶绿素 (Chl)分子及3个类胡萝卜素分子。CP29的晶体结构与以前广泛应用的预测模型存在很大差异:在晶体结构中,有5个叶绿素是新发现的,其中还包括一个主要捕光复合物LHCII中也不存在的全新的叶绿素a615,并且预测模型中认为的4个叶绿素混合占有位点也通过晶体结构被明确的指认为Chl a或Chl b。晶体结构中发现了一个非常特殊的叶绿素对具有三明治式结构特征,这种特殊的叶绿素配位方式在光合膜蛋白中尚属首例。另外,晶体结构中还发现了两个重要色素簇a615/a611/a612/Lut和Vio(Zea)/a603/a609,它们位于CP29分子表面并且分布在两侧,可能是能量传递途径的进出口和潜在的能量淬灭中心。根据晶体结构,CP29中完整精确的色素网络得以构建。该项研究工作为深入研究高等植物次要捕光复合物的高效捕光,能量传递,尤其是光保护等能量调节机制提供了结构基础。
该项研究工作得到科技部、金沙集团1862cc和国家自然科学基金委员会的资助。
 |
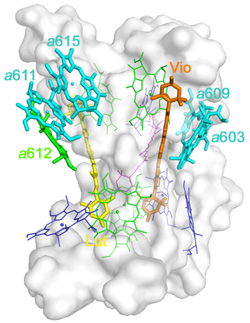 |
| CP29单体结构示意图 | CP29中的色素网络 |
(报道:科技处)
(2011年2月15日)
 附件下载:
附件下载: