2017年11月14日,Nucleic Acids Research杂志在线发表了金沙集团1862cc娄继忠课题组关于CRISPR-Cas9系统中Cas9蛋白复合体结合靶DNA形成R-loop复合体的过程分子机制的最新研究成果,题为“The initiation, propagation and dynamics of CRISPR-SpyCas9 R-loop complex”。
CRISPR-Cas系统是细菌和古细菌抵御外来基因入侵的后天适应性免疫系统,它通过来源于外源基因片段转录产生的非编码RNA的引导实施对外源基因的破坏。近年来,基于II型CRISPR系统发展起来的CRISPR-Cas9基因编辑系统,因其设计简单、特异性强、效率高等优点,已成为最有效的基因编辑工具,被广泛用于基础理论、基因诊断以及临床治疗等领域。然而,越来越多的研究发现,与其他基因编辑工具类似,CRISPR-Cas9也存在较为明显的脱靶效应。阐明造成脱靶效应的来源及分子机制,并对其进行改进,是CRISPR-Cas9相关研究的重点领域之一。
在本项研究中,娄继忠课题组综合利用生物化学、单分子荧光技术及计算生物学方法对酿脓链球菌Cas9 (Streptococcus pyogenes Cas9, SpyCas9) 蛋白复合体识别靶DNA,并形成R-loop复合体过程的分子机制进行了较为系统的研究。研究发现,Cas9-sgRNA复合体将靶DNA序列分成多个功能区域:PAM、linker、seed、middle以及tail区。这些区域在R-loop的稳定性上发挥着不同的功能,对碱基错配的敏感度也有比较大的差异。其中seed区对错配的敏感性最高,middle区则存在序列依赖性。Linker区与tail区有较高的错配容忍度,有趣的是tail的错配反而能够增加其对靶DNA的切割活性。单分子荧光实验发现,Cas9-sgRNA复合体与靶DNA在形成R-loop过程中,至少经历一个高度动态的中间构象状态。这一中间态的稳定性,对于Cas9蛋白的切割活性密切相关,当sgRNA与靶DNA的近PAM区有18bp长度配对时,该中间态具有最高的稳定性,使得Cas9蛋白具有最高的靶切割活性。
娄继忠研究员与宋广涛副研究员为本文的共同通讯作者,曾俨助理研究员和博士生崔洋为本文的共同第一作者。该项研究得到了国家自然科学基金(项目编号:91219103,31300772,31222022)以及国家重点基础研究发展计划(973)项目(项目编号:2014CB910202)的资助。本项研究工作得到了王艳丽研究员的大力支持和帮助。
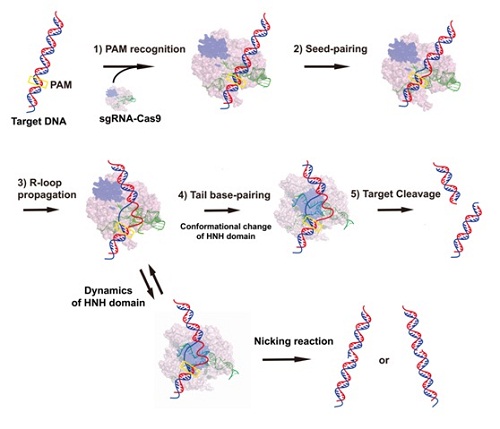
图示 CRISPR-Cas9系统中R-loop复合体形成过程的分子机制示意图
(供稿:娄继忠课题组)
 附件下载:
附件下载: