2019年4月30日,《Plos Biology》在线发表了金沙集团1862cc王祥喜研究员、饶子和院士和四川大学苏丹教授合作的研究论文“Structural basis for neutralization of hepatitis A virus informs a rational design of highly potent inhibitors”。该工作中研究人员解析了甲型肝炎病毒与多株中和性抗体复合物三维结构,揭示了甲型肝炎病毒只有一个保守的抗原表位,利用该表位的结构信息,进行靶向筛选药物化合物库和活性验证,最后发现一种用于头颈部癌症治疗药物可以作为治疗甲型肝炎病毒感染药物开发的先导化合物。这是饶子和/王祥喜联合研究团队继解析甲型肝炎病毒精细三维结构(Wang X, et.al Nature 2015)、揭示甲型肝炎病毒中和性抗体R10“受体模拟”的中和机制(Wang X, et.al PNAS 2017)后又一重要研究成果,也是由结构到靶向药物筛选的研究典范。
甲型病毒性肝炎(Type A viral hepatitis),是由甲型肝炎病毒(Hepatitis A virus, HAV)引起的一种传染病,感染HAV后可引起不同程度的急性症状。现今全球每年仍有150万甲型肝炎病毒的感染病例。甲型肝炎作为一种传染病,其流行、爆发与该地区的收入状况、卫生和生活条件密切相关。目前,甲型肝炎持续威胁着卫生和生活条件差的一些地区。然而最近大量研究发现,发达国家由于许多成年人缺乏天然或疫苗诱导的获得性甲型肝炎免疫,导致甲型肝炎在这些地区大量爆发,开始成为一种新的公共卫生问题。尽管HAV疫苗是预防甲型肝炎的最有效的方式,但目前全世界范围内仅有16个国家和地区将甲肝疫苗纳入常规免疫接种范围,所以全世界范围内甲型肝炎感染的负担仍然很严重。对于甲型肝炎的治疗,尤其是针对大规模的突发性感染,到目前为止还未有特异性治疗药物上市,所以对于相关药物研制尤为迫切。
众所周知,中和性抗体与病毒复合物精细三维结构的研究是确定其精确结合位点最直接、高效的技术手段,对于揭示机体免疫抑制机制及抗病毒药物的研发起到至关重要的作用。基于此,相关研究人员筛选分离得到了四株高中和活性的抗体。通过进一步的实验发现这四株中和性抗体和之前分离得到的R10中和性抗体一样能高效地抑制病毒与宿主细胞的结合。之后研究人员采用低温冷冻电镜单颗粒重构技术解析了四株中和性抗体与HAV复合物的高分辨率三维结构。通过对复合物结构比较发现,这几株中和性抗体均围绕在五次轴周围,结合在衣壳蛋白五聚体边缘,位于二次轴和三次轴之间,横跨两个五聚体,识别HAV衣壳蛋白上由VP3和VP2的共同组成的空间构象型表位,同时通过比较发现这一抗原表位在人源的6种HAV基因型中都极其保守。此外,研究人员观察到,抗原表位的大部分氨基酸分布在一个“沟壑”两旁,之前的研究所证明该区域是受体结合的潜在位点。这些特性都表明该区域是个理想的小分子抑制剂结合靶点。针对这个靶点,研究人员在单克隆抗体的重链中选择了对衣壳蛋白结合有重要贡献的四个氨基酸残基作为药效团进行建模,并利用这一药效团模型在DrugBank库中进行了大规模的计算机模拟药物筛选。之后通过体外抑制实验,从中筛选到了一个抑制效果最佳的先导药物—golvatinib (IC50约为1uM)。相关功能实验证明该小分子并不引起HAV颗粒稳定性改变,而是通过阻断HAV与细胞表面受体的结合进而起到抑制HAV感染的作用。最后研究人员根据分子对接的结构从原子水平分析了其抑制机理,为进一步改造这一先导化合物提供了理论依据。研究人员基于全病毒颗粒抗原表位结构进行药物设计与筛选的这一策略,对于发现针对其他人类重大疾病相关病毒的药物开发是十分值得借鉴的。
《Plos Biology》杂志特邀新西兰奥塔哥大学电子显微镜中心主任MihneaBostina教授就本文,针对该研究领域撰写综述。同时,《Plos Biology》杂志也在网站首页进行了新闻宣传报道。
金沙集团1862cc王祥喜研究员、饶子和院士和四川大学苏丹教授同为本文的通讯作者。曹磊、刘岯和杨盼博士为本文的共同第一作者,该研究得到中科院先导专项、中科院重点部署项目、科技部973项目、国家自然科学基金等资助。
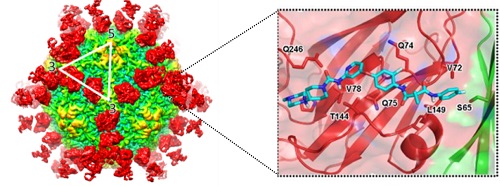
基于HAV抗原表位结构信息设计小分子抑制剂
文章链接:https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3000229
(供稿:王祥喜研究组)
 附件下载:
附件下载: