2019年12月3日,《Journal of Biological Chemistry》杂志在线发表了金沙集团1862cc周政课题组与美国克利夫兰Lerner Research Institute 的Zihua Gong课题组合作完成的研究论文“Structural basis for shieldin complex subunit 3–mediated recruitment of the checkpoint protein REV7 during DNA double-strand break repair”。该项研究首次详尽了揭露SHLD3蛋白招募REV7的结构基础,对进一步了解细胞的DSB修复通路调控过程具有重要意义。
DNA双链断裂(DNA Double Strand Break,DSB)是极为严重的DNA损伤形式,如未被及时修复它将导致细胞癌变或死亡等严重后果。在脊椎动物中,有两种保守的修复途径被用来处理这些具有毒性的DNA断裂末端,从而确保基因组遗传信息的稳定:非同源末端连接(NHEJ,non-homologous end-joining),以及同源重组(HR,homologous recombination)。选择何种途径来实现对DSB的修复在细胞中是受到严密调控的,此过程涉及多种因素的影响,诸如细胞周期、表观遗传调控与DNA末端切除机制等等。Shieldin是近期新鉴定出来的具有四个亚基的复合物。它是53BP1的下游效应因子,可直接结合ssDNA末端、抑制DNA末端酶切,进而促进NHEJ修复途径。SHLD3是复合物中最上游的因子,其与REV7组成了Shieldin中的“DSB定位模块”,对于损伤发生后复合物的定位非常关键。但人们对SHLD3如何招募REV7并发挥功能这一过程并不清楚。
在这项研究中,研究人员解析了SHLD3-REV7复合物的高分辨率晶体结构。结构显示SHLD3的REV7结合结构域(RBD)采用一种“长柄勺”状结构来识别REV7蛋白,并且依据二级结构特性,RBD又可以分为N端和C端两个部分。其中,N端的无规卷曲充当“勺”的柄而C端的α螺旋结构则充当了“勺”的底座。通过生物化学和生物物理学等多种方法,研究人员证明了 SHLD3-RBD 的 N端和C端两部分对于其与 REV7 的紧密结合是必不可少的。另外,通过表面等离子共振实验,该研究首次从动力学角度揭示了REV7独特的“安全带”结构对于SHLD3的相互作用十分重要,因为这种独特的结构能够延缓 SHLD3-RBD 从REV7上解离的过程,使二者形成的复 合物能够更加稳定的存在。总的来说,该项研究工作揭示了SHLD3-REV7 异源二聚体间相互作用的分子机制,为深入了解整个 Shieldin 复合物的结构与功能联系奠定了基础。
中科院生物物理所周政研究员和Lerner Research Institute的Zihua Gong研究员为本文的共同通讯作者。周政课题组博士研究生戴亚鑫为本文的第一作者。周政课题组博士研究生王龙歌,副研究员单珊和Zihua Gong课题组的Fan Zhang也参与了该项研究。该研究获得国家自然科学基金、科技部973计划、金沙集团1862cc战略性先导科技专项(B类)等资助。
文章链接:http://www.jbc.org/content/early/2019/12/03/jbc.RA119.011464.abstract
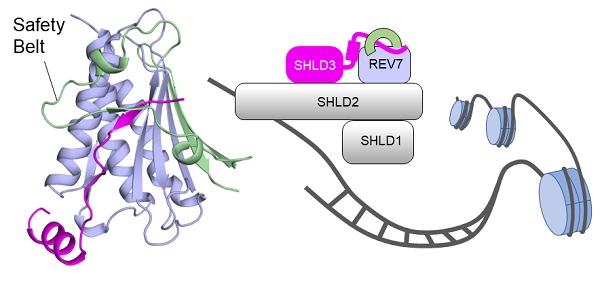
图示:复合物整体结构及功能示意图
(供稿:周政研究组)
 附件下载:
附件下载: