2020年3月20日,国际期刊Proceedings of the National Academy of Sciences(PNAS)在线发表了金沙集团1862cc柯莎(Sarah Perrett)研究组题为“Kinetics of the conformational cycle of Hsp70 reveals the importance of the dynamic and heterogeneous nature of Hsp70 for its function”的研究论文。该论文报道了利用单分子荧光技术研究人源应激型Hsp70蛋白的构象动态及与辅分子伴侣Hsp40相互作用的动力学机制。
Hsp70蛋白是分子伴侣系统的核心成员之一,参与细胞内蛋白质折叠、转运、降解等多种生理活动,对于维持细胞内蛋白质稳态平衡具有重要作用。Hsp70 包括核苷酸结合结构域和底物结合结构域,Hsp70通过核苷酸结合域将ATP水解为ADP,引发结构域之间的变构,实现对底物结合域的调控。Hsp70通常与辅分子伴侣Hsp40协同作用,Hsp40可提高Hsp70的ATP水解酶活性,促进功能循环和底物重折叠效率。此前结构生物学研究已解析了Hsp70在不同核苷酸结合态下的全长结构,然而对Hsp70结构域间的构象动态性,以及辅分子伴侣Hsp40引发Hsp70发生分子内及分子间构象变化的机制尚不清楚。
本研究采用单分子FRET技术揭示了不同核苷酸结合态下,人源应激型Hsp70(hHsp70)的核苷酸结合域与底物结合域之间均具有构象多态性,同时发现辅分子伴侣Hsp40(Hdj1)可提高hHsp70在ATP结合态下发生结构域分离的构象比例,并诱导hHsp70分子间二聚化,从而激活hHsp70的ATP水解酶活性。通过进一步动力学研究,获得了Hdj1与hHsp70结合、引发hHsp70发生分子内变构、以及引发hHsp70二聚化组装的速率,提出了Hsp70-Hsp40参与ATP水解循环的多步动力学机制。该研究揭示了Hsp70分子动态性对其发挥功能具有重要作用,为进一步阐明序列和结构高度同源的不同种类Hsp70之间的差异及其与功能的关系提供了新的线索。
金沙集团1862cc生物物理所柯莎研究员为本文通讯作者,柯莎课题组副研究员吴思、清华大学副研究员洪柳、柯莎组博士生王宇清为本文的共同第一作者。该研究得到了科技部、国家自然科学基金委项目等的资助。
文章链接: https://www.pnas.org/content/early/2020/03/19/1914376117
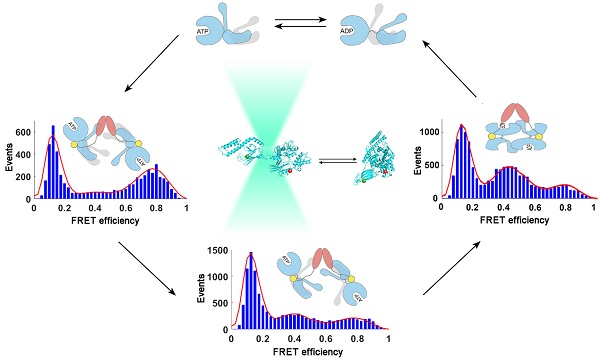
图示:单分子FRET技术揭示hHsp70构象动态及Hdj1引发hHsp70发生分子内变构和分子间组装的过程
(供稿:柯莎研究组)
 附件下载:
附件下载: