2021年6月6日,《EMBO Reports》期刊在线发表了分子神经生物学研究组的研究论文"MICAL2PV suppresses the formation of tunneling nanotubes and modulates mitochondrial trafficking",报道了神经导向信号通路下游分子MICAL2PV通过抑制隧道纳米管(TNT)形成参与调控肺癌细胞的线粒体转运。
肺癌是世界范围内最常见的恶性肿瘤,也是导致癌症相关死亡的最重要原因。根据世卫组织公布的2020最新全球癌症数据,我国新发癌症人数和癌症死亡人数均位居全球第一,其中肺癌排在新发和死亡人数第一位。虽然肺癌筛查和治疗已取得重大进展,但是随着人口老龄化导致的恶性肿瘤发病率显著上升,肺癌患者的5年生存率仍在10%左右。深入理解肺癌致病机理、确定新的分子靶标,对肺癌的早期诊断、指导治疗和预后评估都具有重要意义。
MICAL(Molecule Interacting with CasL)家族蛋白在神经系统中广泛表达,参与调节神经系统发育和/或再生。近年来发现,MICAL家族在肿瘤进展和转移中有重要作用。其中MICAL2是MICAL蛋白家族成员之一,在乳腺癌、胃癌等多种肿瘤的进展中发挥作用。MICAL2通过可变剪接产生两种剪接异构体, MICAL2PVa和MICAL2PVb(简写为MICAL2PV),并且其表达水平与肿瘤进展相关。作为细胞骨架调节蛋白,MICAL2能解聚F-actin;而F-actin的聚合参与形成细胞间交流方式TNT(Tunneling nanotube)。TNT在肿瘤进展及耐药中的作用均有报道,这提示MICAL2可能通过调节TNT形成从而影响肿瘤进展。
研究组前期发现,在人正常肺组织或肺癌样本中,MICAL2的主要表达形式为MICAL2PV亚型,且MICAL2PV在肺癌患者样本中下调;小鼠体内成瘤实验发现,下调MICAL2PV促进肿瘤生长,提示其在肺癌中可能发挥抑癌基因的作用。在本文的研究中,通过在两种肺癌细胞中设计实验,发现MICAL2PV通过其MO结构域介导F-actin解聚从而抑制TNT形成;而下调MICAL2PV表达可显著增加TNT形成,并且增强TNT介导的线粒体转运。免疫荧光染色和活细胞成像结果显示,下调MICAL2PV促进了线粒体从核周浸润到皮层细胞骨架。MICAL2PV通过与线粒体运动相关蛋白Miro2相互作用,抑制其定位到线粒体。而Cytochalasin B解聚F-actin后明显抑制线粒体浸润,促使线粒体在核周聚集,提示下调MICAL2PV后引起的F-actin聚合作用同样参与了线粒体浸润。将化疗药物处理的细胞与健康细胞共培养,发现下调MICAL2PV可通过促进TNT形成参与肺癌细胞耐药。这些研究结果揭示了MICAL2PV作为肺癌细胞中MICAL2的主要存在形式,通过MICAL2PV-Miro2轴,参与调控肺癌细胞的线粒体亚细胞分布和TNT介导的线粒体转运,从而影响肺癌进展和耐药。
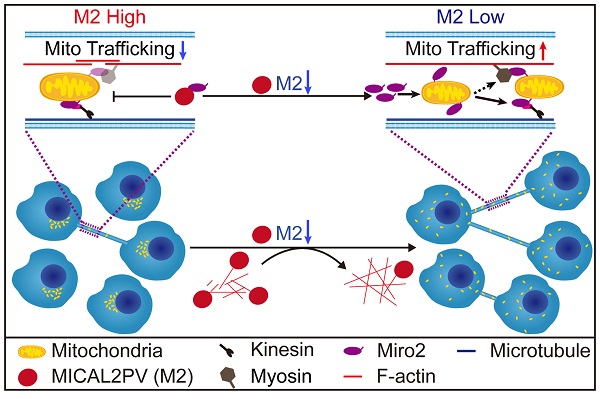
图1. MICAL2PV抑制TNT形成和TNT介导的线粒体转运。下调MICAL2PV促进F-actin聚合,增加TNT形成和细胞间线粒体运动和分布。
该研究为理解肺癌的进展、化疗耐药和复发,提供了新的视角,同时也为发现新的肺癌分子靶标提供重要研究基础。
金沙集团1862cc脑与认知科学国家重点实验室的博士生王飞为本文的第一作者,朱笠研究员和美国西北大学医学院吴瑛教授为共同通讯作者。该研究获得国家重点研发计划和国家自然科学基金项目资助。
文章链接:https://www.embopress.org/doi/full/10.15252/embr.202052006
(供稿:分子神经生物学研究组)
 附件下载:
附件下载: