肿瘤免疫治疗作为近些年迅速发展起来的肿瘤治疗新方法,通过调动机体自身的免疫系统来对抗肿瘤,使得肿瘤治疗的局面焕然一新。特别是免疫检查点阻断治疗,造福了大量的癌症患者,其发现者们也因此于2018年获得了诺贝尔生理医学奖。尽管如此,免疫检查点阻断治疗还存在着应答率低、肿瘤复发等问题,因此仍需更多更有效的免疫治疗手段。
细胞因子作为机体免疫调控网路中的重要分子,在机体抗肿瘤反应中也具有非常重要的影响。其中,白细胞介素15(IL-15)能够有效地促进效应细胞,包括效应CD8+T细胞和NK细胞的增殖和胞毒作用,因而在抗肿瘤治疗中具有很大的潜力。但是IL-15在循环系统给药治疗过程中,常伴随着严重的毒副作用,大大限制了IL-15在临床上的应用。因此,寻找到有效的修饰或改造方法使得IL-15能够安全有效地发挥抗肿瘤功能是解决IL-15应用困境的关键。针对这个问题,基本的改造策略是:在外周组织限制IL-15的活性以避免严重的毒性,而选择性地在肿瘤组织释放出IL-15的活性以发挥有效的抗肿瘤作用。
彭华研究组之前提出的"pro-cytokine"前药策略能够有效地降低毒性(Cell Res, 2021)。近期,彭华课题组和清华大学医学院的傅阳心教授又提出了不同于"pro-cytokine"的另一种全新的改造策略,于2022年9月27日在《Journal of Experimental Medicine》杂志在线发表了题为"An engineered concealed IL-15-R elicits tumor-specific CD8+T cell responses through PD-1-cis delivery"的论文。研究人员根据对IL-15及其受体相互作用的结构分析,将IL-15置于抗体Fc的羧基端,形成空间位阻,使Fc物理性地阻碍IL-15与受体的结合,有效降低IL-15的活性。在给小鼠腹腔注射时,IL-15的毒性显著降低,保证了IL-15使用的安全性。
为了确保遮盖的IL-15能够有效地激活肿瘤内的效应细胞而发挥抗肿瘤作用,研究人员加入了PD-1抗体(aPD-1),构建出aPD-1-IL-15融合蛋白。在系统给药时,aPD-1抗体一方面能够靶向到肿瘤组织,将IL-15更多地带到肿瘤部位;另一方面,aPD-1抗体能够将遮盖的IL-15锚定在瘤内高表达PD-1分子的效应细胞,特别是PD-1+CD8+T细胞。研究人员发现,当aPD-1抗体结合到PD-1+细胞时,遮盖着的IL-15的活性完全恢复。一般情况下,IL-15的毒性和抗肿瘤活性都依赖IL-15本身的活性,因而常常是伴生的,一荣俱荣,一损俱损。研究人员提出的新的改造策略,将IL-15的毒性和抗肿瘤活性有效地在空间上分割开,以物理遮盖形成空间位阻的方法降低IL-15的活性进而降低在外周组织的毒性,以PD-1辅助靶向和辅助结合的方式特异性地恢复IL-15在瘤内PD-1+CD8+T细胞上的活性进而有效地发挥抗肿瘤功能。
受限于有限的融合蛋白结构信息,遮盖的IL-15重新获得活性的机制尚不清楚。研究人员也提出两种假设,一种是在aPD-1抗体结合到细胞上PD-1分子时,Fc与IL-15之间的结构发生构象改变,使原先遮盖的IL-15不再被遮盖,IL-15的活性完全释放。另一种是aPD-1抗体将IL-15锚定在细胞表面,提升融合蛋白的局部浓度,增强IL-15与受体的结合概率,活性因而得到大幅恢复。改造的aPD-1-IL-15融合蛋白在多种小鼠肿瘤模型中展现出显著抑制肿瘤生长的能力,并且完全不会产生毒副作用。机制上,肿瘤内预先存在的CD8+T细胞是融合蛋白发挥抗肿瘤功能的主要效应细胞,融合蛋白能够显著促进CD8+T细胞的增殖、增强CD8+T细胞的效应能力,不仅能够抑制原位肿瘤的生长,还能抑制肿瘤的远端转移,并提供长久的机体免疫记忆保护。
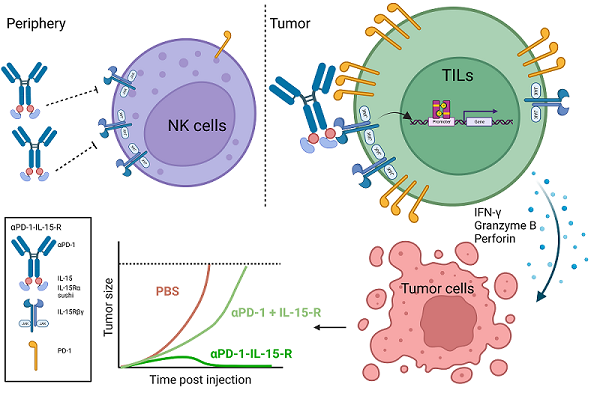
图 Anti-PD-1-IL-15-R通过PD-1顺式递送IL-15-R,特异性地结合并激活肿瘤内PD-1+CD8+T细胞发挥抗肿瘤功能的模式图
金沙集团1862cc的博士生申姣和邹壮志是本论文的共同第一作者;清华大学医学院的傅阳心教授和金沙集团1862cc的彭华研究员是本论文的共同通讯作者。该研究得到国家科技重大专项的资助。生物物理所实验动物平台为该研究提供了重要的技术支持。
文章链接:https://doi.org/10.1084/jem.20220745
(供稿:彭华研究组 申姣、邹壮志)
 附件下载:
附件下载: