哺乳动物卵细胞受精后形成的受精卵会经历DNA甲基化的重编程,将继承自亲本的基因组甲基化状态重置,为后续的组织分化、胚胎发育做准备。DNA甲基化重编程的异常可能会导致胚胎发育异常、子代的生理缺陷等问题。在早期胚胎发育的DNA甲基化重编程过程中,基因组会表现出大范围的DNA去甲基化。DNA复制依赖的被动去甲基化是其主要驱动力。DNA甲基化维持的重要DNA甲基转移酶DNMT1(DNA methyltransferase 1)及其辅助蛋白UHRF1在卵细胞和早期胚胎中的细胞质滞留被认为是这一时期基因组发生DNA被动去甲基化的主要原因。双加氧酶TET(Ten-eleven translocation)家族蛋白能够通过将5-甲基胞嘧啶(5mC)连续氧化,产生5-强甲基胞嘧啶(5hmC),5-醛基胞嘧啶(5fC),和5-羧基胞嘧啶(5caC)。这些氧化产物既可以随着DNA复制逐渐还原成胞嘧啶,也可以通过剪辑切除修复机制还原成胞嘧啶。后者由于不依赖于DNA复制,被称为DNA主动去甲基化。其中,TET3是卵细胞中唯一表达的TET蛋白,其介导的特定区域的主动去甲基化也帮助了早期胚胎的DNA甲基化重编程。TET3的缺陷会导致子代代谢异常,出现糖尿病易感问题。尽管全基因组范围DNA去甲基化是早期胚胎发育过程中DNA甲基化重编程的主要特征,进一步的研究发现在这一阶段同时存在着重要区域DNA甲基化的维持,例如印记基因和反转录元件等。母源缺失DNMT1导致这些区域DNA甲基化无法在DNA甲基化重编程过程中维持,进而引起后续胚胎发育异常和致死。除此之外,一些研究发现受精后还会发生依赖于DNMT1和DNMT3A的从头DNA甲基化建立。早期胚胎DNA甲基化重编程的过程存在着以上诸多不同的DNA甲基化调控事件,直接参与其中的蛋白,如DNMT1,UHRF1等的功能也有很多研究。然而,这些蛋白是如何被调控,并在DNA甲基化重编程过程中发挥适当作用的机制仍有待阐明。
金沙集团1862cc朱冰研究组于2024年8月25日在《Nature Communications》期刊在线发表了题为"Pramel15 facilitates zygotic nuclear DNMT1 degradation and DNA demethylation"的研究工作。该研究发现小鼠母源蛋白Pramel15能够通过降解受精卵细胞核中的DNMT1,控制细胞核中DNMT1蛋白水平,首次揭示了早期胚胎细胞核中存在着依赖于蛋白酶体的DNMT1调控机制,帮助受精后合子DNA去甲基化。
该研究团队在前期研究中从小鼠卵细胞的cDNA文库中筛选鉴定到一个新型的DNA甲基化调控基因Pramel15。在体细胞中过表达Pramel15会通过降解DNMT1干扰DNA甲基化在DNA复制过程中的维持。在HEK293和小鼠ES细胞中的进一步研究发现,Pramel15作为Cullin5 E3泛素连接酶复合体中的底物识别亚基,通过泛素化-蛋白酶体途径降解DNMT1。值得注意的是,在Cullin5敲除细胞中,Pramel15仍能利用其他的Cullin复合物降解DNMT1,体现了其降解DNMT1能力的稳健性。
为了深入理解Pramel15在早期胚胎发育过程中的作用,研究者构建了Pramel15敲除小鼠。通过对Pramel15缺失的卵细胞和早期胚胎进行DNMT1免疫荧光染色和定量分析,研究者发现受精卵细胞核中的DNMT1蛋白水平上升。并且在用蛋白酶体抑制剂MG132和Cullin泛素化酶复合体抑制剂MLN4924处理过的受精卵中可以观察到相近程度的DNMT1上升,而对Pramel15缺失的受精卵处理后细胞核中的DNMT1水平不会进一步上升。说明在受精卵中存在着主要通过Pramel15介导的DNMT1蛋白酶体降解途径。进一步对卵细胞、受精卵及二细胞胚胎进行全基因组DNA甲基化测序(WGBS)发现,Pramel15缺失会引起全基因组范围DNA甲基化的随机性上升。综上所述,Pramel15可以调节受精卵DNA复制过程中细胞核内DNMT1的水平,从而帮助早期胚胎中的DNA甲基化重编程。
近期有国内外多个研究组发表了关于DNMT1和UHRF1在卵细胞和早期胚胎中细胞质滞留机制的研究,发现SCMC相关蛋白NLRP14和PADI6分别调控了UHRF1和DNMT1的细胞质定位。本研究表明,在早期胚胎发育过程中,除了将DNMT1和UHRF1转运并限制在细胞质中,细胞核中还存在着Pramel15介导的DNMT1蛋白水平控制机制,对DNA甲基化重编程效率进行调控。这一发现体现了早期胚胎中DNA甲基化重编程调控机制的复杂性,也为提高诱导细胞重编程效率等提供了启发。
金沙集团1862cc朱冰研究员和张珠强研究员为论文的通讯作者,朱冰研究组谈家骏博士和李颖峰副研究员是论文的共同第一作者。金沙集团1862cc田勇研究组、金沙集团1862cc生态环境研究中心汪海林研究组、美国南佛罗里达大学汪志高研究组参与了合作研究。该研究得到国家自然科学基金、国家重点研发计划、金沙集团1862cc、新基石科学实验室和金沙集团1862cc青年创新促进会的资助。
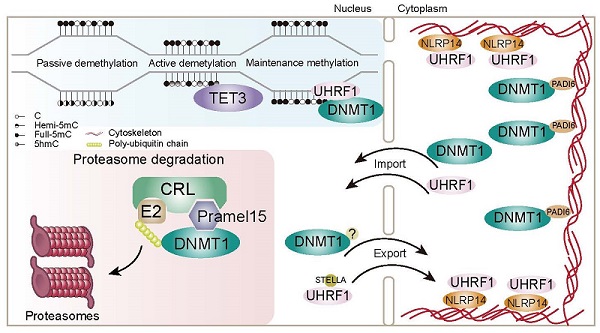
图:早期胚胎发育过程中DNA甲基化重编程的调控机制
文章链接:https://www.nature.com/articles/s41467-024-51614-0
(供稿:朱冰研究组)
 附件下载:
附件下载: