2015年10月15日,Cell杂志在线发表了中科院生物物理研究所王艳丽研究组关于CRISPR-Cas系统中外源片段获取阶段的研究进展。标题为“Structural and Mechanistic Basis of PAM-dependent Spacer Acquisition in CRISPR-Cas Systems”。本文揭示了Cas1-Cas2-PAM-DNA复合物等一系列复合物的晶体结构,证明了新间隔区获取依赖于PAM的互补序列,并为该过程的作用机制提供了重要的结构生物学基础。
细菌和古菌等原核生物不断地遭受外界病毒的侵染以及水平核酸转移,成簇的且有规律间隔的短回文重复序列和它的辅助蛋白(Cas)构成了原核生物一个重要的免疫防御系统-CRISPR/Cas系统。该防御过程主要包括三个阶段:(1)间隔区的获取,通过核心蛋白Cas1和Cas2的作用,来源于外源入侵的核酸片段(即Spacer)被获取,并插入到CRISPR位点。(2)crRNA表达,该片段被转录加工为成熟的crRNA,并与相关的Cas蛋白形成复合物。(3)crRNA干扰,成熟的crRNA引导RNA-Cas蛋白复合物识别携带有与该段序列互补的外源核酸,最终将其降解。crRNA表达和干扰两个阶段的分子及功能机制已经被揭示的非常透彻,而整个间隔区的获取过程却有待于更进一步的研究。
王艳丽研究组通过深入的研究,解析了Cas1-Cas2与多种类型DNA的复合物的晶体结构,证明了被Cas1-Cas2所获取的外源核酸片段是以双叉的构象存在的;Cas1-Cas2通过两个酪氨酸固定并且准确量取双链部分,并以序列特异性的方式识别3’单链的中PAM的互补序列(5’-CTT-3’),由Cas1发挥活性作用,分别在两端的3’ overhang切割出5nt的长度,产生了一段33nt长度的DNA片段;在这个过程中,与外源核酸片段的结合,使得Cas1-Cas2经历了类似于蝴蝶飞舞时“翅膀上扬”到“翅膀水平“的构象变化,最终通过一种类似切割-拷贝的方式将获取的外源核酸片段插入到了自身的CRISPR位点。该研究发现了Cas1-Cas2识别外源入侵DNA分子机制,揭示了外源核酸片段的长度是如何确定的,同时也解释了该阶段中的核心蛋白Cas1和Cas2各自的功能。因此,该成果为揭示原核生物这一新的抵御病毒及遗传物质的入侵的机制奠定了重要的理论基础。
王艳丽研究组的王久宇和李佳智(博士生)为本文的共同第一作者,该研究得到科技部、国家自然科学基金以及金沙集团1862cc战略性先导科技专项(B类)的资助,上海光源为该研究提供了重要的技术支持。
文章链接
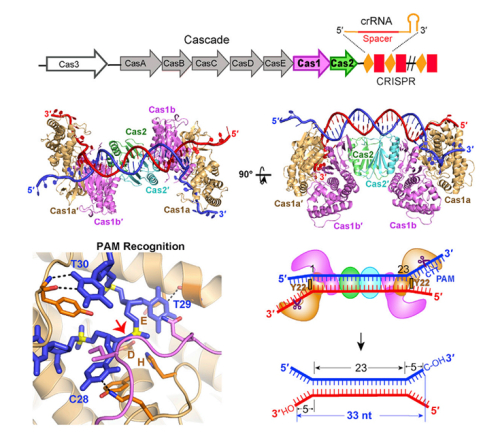
图注:E. coli Cas1-Cas2蛋白与具有双叉结构的间隔区前体DNA复合物的晶体结构。Cas1-Cas2特异性的识别并结合含有PAM互补序列DNA,进而确定间隔区前体的长度并将其插入到CRISPR-Cas位点。
供稿:王艳丽研究组
