2020年10月16日,王艳丽课题组和中国科学技术大学龚为民课题组合作的论文"Structural basis for two metal-ion catalysis of DNA cleavage by Cas12i2"在《Nature Communications》杂志在线发表。该工作报道了Cas12i2-crRNA和Cas12i2-crRNA-DNA复合物的晶体结构,揭示了Cas12i2对DNA的识别和切割机制,并首次观察到CRISPR-Cas系统效应蛋白的RuvC催化结构域活性状态的结构。该研究结果不仅揭示了Cas12i2降解DNA的分子机理,更重要的是有助于理解含有RuvC结构域的Cas蛋白的催化机制。
CRISPR-Cas系统是细菌和古菌中的获得性免疫系统,其中,Cas9和Cas12a是目前最常用的基因编辑工具,RuvC结构域是Cas9与Cas12切割DNA的重要催化部位。因此,获得RuvC结构域同时结合底物DNA和金属离子的结构,对于了解RuvC 结构域的催化机制有重要意义。
2018年12月,Scott课题组发现V-I亚型效应蛋白Cas12i,而且Cas12i比目前用于基因编辑工具的Cas12a和Cas9分子量更小,因此有望成为新的基因编辑工具,据此,研究Cas12i的结构和功能有重要意义。
本研究报道了Cas12i2的crRNA结合状态、种子区域配对状态、催化状态三种不同状态的高分辨率结构。研究发现,只有当crRNA:DNA配对长度大于13 nt时,Cas12i2的Helical-II结构域才会发生构象改变,导致底物结合通道打开,并激活RuvC结构域。重要的是,在高分辨率Cas12i2-crRNA-DNA三元复合物晶体结构中,RuvC结构域同时结合了一段底物ssDNA和2个镁离子,揭示了RuvC结构域双镁离子依赖的DNA切割机制,这也是首次观察到RuvC结构域同时结合底物DNA和金属离子,展示了其活性状态的结构。
此外,该工作还系统地研究了Cas12i2的生化性质,揭示了Cas12i2前体crRNA加工机制,并发现前体crRNA的加工影响双链DNA切割活性。研究还发现,Cas12i2还具有PAM非依赖型的非特异性单链DNA的切割活性;有趣的是,种子区域的完美配对对于双链DNA的切割至关重要,却不是单链DNA切割的必要条件。该研究对于基因编辑和核酸检测工具的开发有重要意义。
金沙集团1862cc生物物理所王艳丽研究员、盛刚高级工程师和中国科学技术大学龚为民教授为本文的共同通讯作者。博士生黄雪为本文的第一作者。该研究得到科技部、国家自然科学基金以及金沙集团1862cc的资助,上海同步辐射光源(SSRF)及日本同步辐射光源(SPring-8)为该研究提供了重要的技术支持。
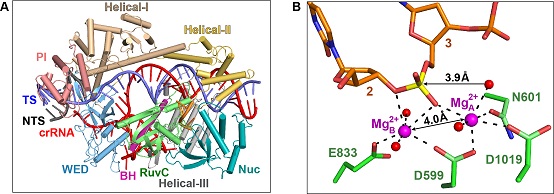
Cas12i2的结构生物学研究
A. Cas12i2-crRNA-DNA三元复合物的整体结构
B. Cas12i2的RuvC结构域催化中心
文章链接:https://www.nature.com/articles/s41467-020-19072-6
(供稿:王艳丽研究组)
