2021年5月14日,《Journal of Cell Biology》杂志在线发表了金沙集团1862cc张宏课题组题为"Atlastin 2/3 regulate ER targeting of the ULK1 complex to initiate autophagy"的研究论文,该文揭示了ATL2/3与参与自噬起始的ULK1复合体直接相互作用,促进其在内质网上组装,从而介导自噬体的形成。
自噬(autophagy)是真核细胞中由溶酶体介导的降解途径。自噬通过形成双层膜的自噬体以包裹部分的细胞质组分,比如受损的细胞器、错误折叠的蛋白等物质,并将其运送到溶酶体进行降解。内质网在多细胞生物的自噬过程中发挥重要的功能:当细胞感受到应激刺激等自噬诱导信号时,ULK1复合体首先被招募到内质网上,形成自噬起始位点,进而招募下游的自噬蛋白共同诱导隔离膜的形成;在隔离膜的延伸过程中,ULK1复合体与WIPI2蛋白相互作用,介导隔离膜与内质网的膜接触的形成,为自噬体的形成提供脂来源。哺乳动物细胞中,ULK1复合体主要包括FIP200、ULK1、ATG13和ATG101蛋白,这四个蛋白相互作用,动态地结合在一起。目前ULK1复合体在内质网上动态组装的机制尚不清楚。
内质网塑形蛋白Atlastin是一类dynamin超家族蛋白,该家族由ATL1、ATL2和ATL3组成,负责调控内质网的融合,ATLs的缺失会造成内质网形态的改变。课题组发现敲除ATL2/3会抑制自噬活性。自噬诱导后,细胞质中弥散分布的LC3I经过脂化作用,以LC3II的形式偶联到自噬体膜上。研究发现,在ATL2/3双敲细胞中,LC3II/LC3I比例明显降低,脂化过程减慢。同时,自噬底物p62明显累积,自噬体数量减少,表明敲除ATL2/3抑制自噬的活性。随后研究发现,与对照细胞相比,在ATL2/3双敲细胞中,FIP200和ATG13的内质网招募没有明显改变,但ULK1与ATG101的招募显著减少。ATG13-ULK1及ATG13-ATG101之间的相互作用也明显减弱。进一步研究表明ATL2/3帮助ATG13招募ULK1与ATG101。该研究还发现在ATL2/3双敲细胞中,WIPI2和ULK1及FIP200之间的相互作用减弱,电镜结果表明自噬体/隔离膜与内质网膜接触也减少,说明敲除ATL2/3抑制内质网与隔离膜接触的形成。
这项研究揭示了内质网蛋白ATL2/3调控自噬的分子机制。ATL2/3与ATG13和ULK1相互作用,促进ULK1复合体在内质网的招募,参与内质网隔离膜接触位点的形成。该工作揭示了自噬体形成过程中,ULK1复合体在内质网上的动态组装的分子机制。
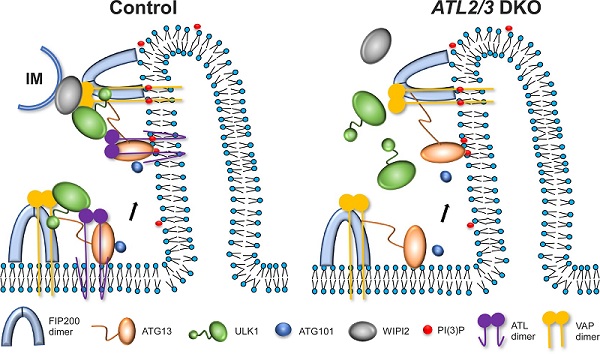
图 ATL2/3参与自噬调控的工作模型
金沙集团1862cc张宏研究员和胡俊杰研究员为本文的共同通讯作者,生物物理所博士生刘楠为本文的第一作者。该项目受到国家自然科学基金、科技部、北京市科委、中科院先导及中科院前沿局等的支持。
文章链接:https://doi.org/10.1083/jcb.202012091
(供稿:张宏研究组)
 附件下载:
附件下载: