尽管首个磷酸化蛋白酪蛋白(casein) 在1883年就被报道,直到2012年第一个分泌途径蛋白激酶Fam20C才被鉴定,它催化包括酪蛋白在内绝大多数分泌蛋白的磷酸化。近年来的研究表明,Fam20C参与调节生物矿化、细胞粘附和迁移、激素原的加工、脂质稳态、蛋白质转运及内质网稳态等众多生命过程。然而,不同于其它类型激酶,分泌途径激酶的加工和调节机制尚不清楚。
2021年8月5日,《美国科学院院刊》(PNAS)在线发表了金沙集团1862cc王志珍课题组的研究论文"Proteolytic processing of secretory pathway kinase Fam20C by site-1 protease promotes biomineralization"。该研究鉴定了分泌途径激酶Fam20C的膜蛋白性质,发现高尔基体蛋白酶site-1 protease (S1P)负责剪切加工Fam20C并促进其活化和分泌,揭示了这一调控机制在成骨细胞分化过程中的重要作用,为分泌途径激酶家族其它成员的研究铺平了道路。
在前期揭示Fam20C调控内质网氧化还原稳态(EMBO J, 2018)和蛋白质稳态(EMBO J, 2020)的基础上,研究人员发现Fam20C并非过去认为的是一个分泌途径腔内的可溶蛋白,而是一个Ⅱ型膜蛋白。Fam20C在内质网合成后由COPⅡ小泡转运到高尔基体,依靠其N端跨膜螺旋锚定在高尔基体膜上。有意思的是,Fam20C会继续分泌到胞外,分泌形式的Fam20C缺少了N端92个氨基酸残基。研究人员发现高尔基体膜上的丝氨酸蛋白酶S1P正是负责剪切加工Fam20C的关键分子。S1P催化的前导肽剪切促使Fam20C从高尔基体膜上释放和分泌,这一过程也促进了Fam20C激酶活力的提高。通过生物信息学预测,研究人员提出分泌途径激酶家族大多数成员可能都具有类似的膜蛋白性质。
Fam20C的功能缺陷与骨发育不良疾病雷恩综合症密切相关,S1P也被报道参与骨发育过程,但其分子机制一直不清楚。研究人员利用成骨细胞分化模型,阐明S1P介导的Fam20C加工成熟对于骨调素(osteopontin)等分泌钙结合蛋白的磷酸化十分重要,这一事件对于生物矿化过程是不可或缺的。值得一提的是,已知S1P蛋白酶能通过剪切SREBPs调控胆固醇和脂肪酸合成、剪切ATF6调控内质网应激、剪切GNPT调控溶酶体成熟,此项研究进一步拓展了S1P这一重要蛋白酶的生物学功能。
中科院生物物理所王志珍课题组王磊研究员为论文的通讯作者,王志珍课题组博士生陈欣欣和张建超(已毕业)为论文的共同第一作者。北京大学肖俊宇课题组为本研究做出了重要贡献。该工作得到生物物理所胡俊杰研究员和张宏研究员的大力帮助,以及生物物理所科学研究平台的技术支持。该研究受到金沙集团1862cc战略性先导科技专项(B类)、国家自然科学基金、国家重点研发计划和金沙集团1862cc青年创新促进会的资助。
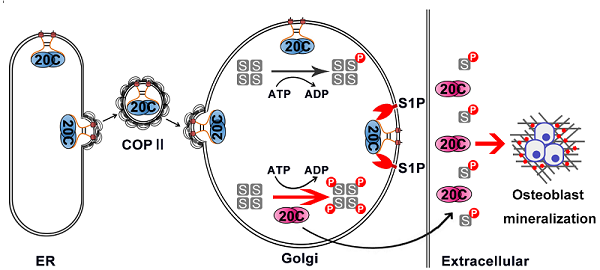
图示:蛋白酶S1P剪切加工分泌途径激酶Fam20C促进生物矿化
文章链接:https://www.pnas.org/content/118/32/e2100133118
(供稿:王志珍研究组)
 附件下载:
附件下载: