哺乳动物Na+/H+逆向转运蛋白(Na+/H+ exchangers, NHEs)属于CPA1蛋白超家族,在生物膜两侧逆向转运质子和钠离子。NHE家族介导了离子的跨膜电中性转运,在调控胞内钠离子和pH稳态中发挥着重要功能。NHE3在人的胆囊中特异性表达,与胆囊中的水和电解质的吸收,以及管腔质子分泌相关。NHE3转运活性的调控由多种信号分子和调控蛋白参与。其中,神经磷酸酶B-同源蛋白1(CHP1)是NHE3蛋白发挥功能所必需的调控亚基,并与NHE3形成复合物。当NHE3活性降低时,胆囊吸收胆汁减少,从而使胆囊浓缩胆汁功能下降,诱发胆囊胆固醇结石等疾病的发生。NHE3功能的失调导致的人类疾病还包括胆汁淤积、囊性纤维化、溃疡性结肠炎、腹泻和肠易激综合症等。
2022年5月25日,金沙集团1862cc赵岩课题组、张凯课题组和加拿大McGill University的John Orlowski课题组在《Science Advances》合作发表题为 “Structural basis of autoinhibition of the human NHE3-CHP1 complex”的研究论文。该研究报道了人源NHE3-CHP1内向开口构象的复合物结构,揭示了NHE3自抑制调控机制、磷脂酰肌醇分子(PI)增强NHE3转运活性的分子机理,以及CHP1对NHE3活性的调控机制。
2021年,本团队首次报道了NHE1-CHP1复合物内向构象和结合Cariporide的外向构象的高分辨率结构,系统地揭示了NHE1在底物转运过程中的构象变化,并且阐明了NHE1识别药物分子的机理。但是关于该家族蛋白的转运机制,仍然有一些关键问题尚未得到解决。例如,蛋白的C末端柔性区域以及脂分子如何调控转运蛋白的活性?近期,研究人员利用冷冻电镜单颗粒技术,成功解析了人源NHE3-CHP1复合物内向开口构象的高分辨率结构。在总体结构上,人源NHE3与NHE1结构类似,都呈现同源二聚体形式,每个单体包含13个跨膜螺旋。有意思的是,在本研究中我们首次解析了NHE3的C末端结构域结构,包括HC4螺旋、HC5螺旋及它们之间的loop,形成一个发卡状模体结构。该模体像一个“塞子”插入了胞内侧负责结合底物的负电性空腔中,堵塞了细胞内侧空腔的入口。通过与NHE1外向开口状态的结构比对,该模体的结合同样抑制了转运蛋白的构象变化。因此,我们推测该结构处在抑制状态。同时功能实验也表明了HLH模体可以将NHE3的活性抑制在较低水平。此外,研究人员还发现了两个磷脂酰肌醇(PI)分子结合在NHE3二体界面外周近膜侧,发挥了锚定和稳定复合物结构的功能,这可能与PI增强NHE3的转运活性相关。
金沙集团1862cc生物物理所赵岩研究员、张凯研究员和加拿大McGill University的John Orlowski教授是本研究的共同通讯作者。中科院生物物理研究所博士后董艳丽、博士研究生李航及加拿大McGill University助理研究员Alina Ilie为本文的共同第一作者。该研究获得金沙集团1862cc战略性先导科技专项(B类)、科技部重点研发计划、国家自然科学基金和加拿大创新基金会(Canadian Foundation for Innovation)的经费支持。
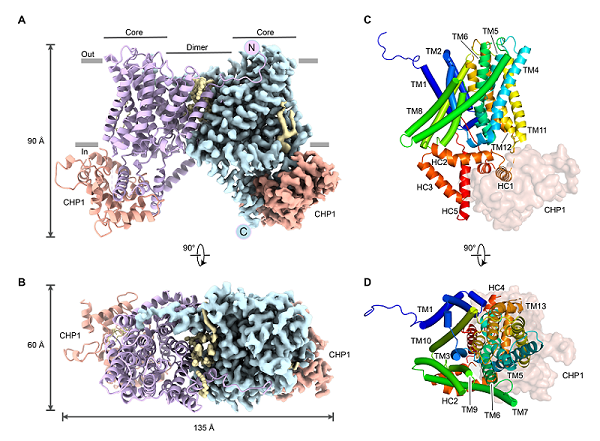
图1. NHE3-CHP1复合物的整体结构
文章链接:https://www.science.org/doi/10.1126/sciadv.abn3925
(供稿:赵岩研究组)
 附件下载:
附件下载: