2006年,美国科学家Andrew Fire和Craig Mello获得了诺贝尔生理学或医学奖,表彰他们的RNA干扰(RNA interference, RNAi)研究工作,同时也揭开了RNA干扰机制的崭新篇章。如今,RNA干扰技术越来越多地被用于调控人类基因的表达。在动植物中存在一类长度约为22 nt的非编码单链RNA分子microRNA(miRNA),它们能通过RNAi参与转录后基因的表达调控。在线虫系统性RNAi的研究中,发现跨膜蛋白SID-1(systemic RNA interference defective protein 1)在介导外源双链RNA(double-stranded RNA, dsRNA)的吸收方面扮演着关键的角色,被认为是重要的核酸转运通道。在哺乳动物细胞中,存在与SID-1有相似核酸转运功能的两个同源跨膜蛋白,分别是SIDT1和SIDT2(SID1 transmembrane family member 1/2)。SIDT2参与了细胞内DNA/RNA自噬过程,并将溶酶体内化的核酸转运至细胞质,引发先天免疫反应,SIDT1更是直接介导食物性来源miRNA的吸收。研究发现,胃部是吸收食物小RNA的主要部位,在哺乳动物的胃粘膜顶细胞(pit cell)上表达的SIDT1是吸收外源小RNA的关键蛋白质。值得注意的是,这一过程在极低pH的胃酸环境下得到显著促进,酸刺激极大程度地促进了miRNA的吸收。这一颠覆性的发现为小RNA的“跨界调控”提供了进一步的证据,为基于小RNA的治疗提供了新策略,也为基于RNA的药物开发提供了潜在方向。虽然越来越多的科研团队相关的研究都支持哺乳动物SID-1跨膜家族蛋白SIDT1和SIDT2介导核酸转运,但是SID-1跨膜家族蛋白SIDT1和SIDT2介导异源小RNA吸收的分子机制仍然不够清楚,特别是关于低pH条件下促进小RNA吸收过程的机制仍然未知。
2023年11月6日,生物物理所孙飞课题组与南京大学生命科学学院籍晓云课题组和张辰宇课题组合作,在《Cell Research》杂志上在线发表了题为“Cryo-EM structures of human SID-1 transmembrane family proteins and implications for their low-pH-dependent RNA transport activity”的研究论文。该研究利用冷冻电镜单颗粒技术首次同时解析了人源SIDT1和SIDT2蛋白质的同源二聚体三维结构。首次发现SIDT1和SIDT2可以以pH依赖的方式结合miRNA,并诱发SIDT1和SIDT2的进一步寡聚化。该研究从分子层面揭示了酸性环境促进小RNA吸收的分子机理,揭示了SIDT1和SIDT2介导核酸转运的潜在分子机制,对深入理解SIDT1和SIDT2在酸性微环境中的功能调控以及RNA递送系统的开发具有潜在意义。
研究团队首先攻克了膜蛋白样品表达纯化的困难和在冷冻样品制备过程中存在严重取向优势等难题,成功利用冷冻电镜单颗粒技术获得了人源SIDT1和SIDT2的三维结构。SIDT1和SIDT2都含有一个胞外结构域(extracellular domain, ECD)、一个由11次跨膜螺旋组成的跨膜结构域(transmembrane domain, TMD),以及一个柔性的胞内结构域(intracellular domain, ICD)。通过结构分析,研究人员发现SIDT1和SIDT2的结构高度相似,这也提示它们可能具有相似的生物学功能。同时研究人员还发现了进化保守的位点,如二硫键和糖基化位点,它们对SIDT1和SIDT2酸性条件下的稳定性和结构完整性起着至关重要的作用。此外,研究人员检测了SIDT1和SIDT2在体外和活细胞中的聚合状态,结果表明这两种蛋白质都以二聚体或寡聚体的形式存在,并且TMD对于维持二聚体至关重要。这些发现为理解SIDT1和SIDT2在体内的功能提供了重要信息。
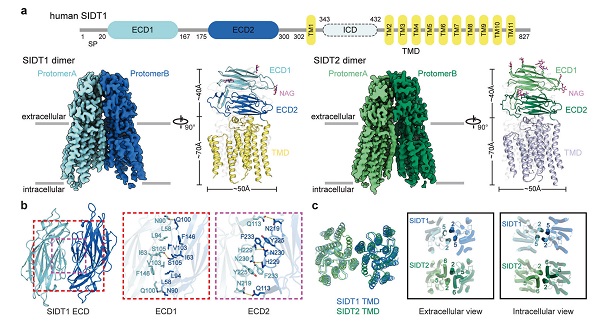
图1 SIDT1和SIDT2同源二聚体的冷冻电镜结构
为了揭示SIDT1和SIDT2介导小RNA 转运的分子机制,研究人员进一步探究了它们的ECD与小RNA的结合情况。实验结果显示,SIDT1和SIDT2的 ECD能以pH依赖性方式有效地与小RNA结合。在酸性条件下,ECD与小RNA的亲和力增加,这种结合进一步引发了ECD的寡聚化。这一发现推翻了前期报道的SIDT1ECD和SIDT2ECD只能结合较长的双链RNA(>100 bp)的观点。同时,研究人员还发现ECD蛋白在酸性条件下与核酸的结合不受核酸种类、单双链的特异性影响,并且这种结合存在pH依赖性。最后,通过分析型超速离心和凝胶过滤层析分析,研究团队还发现在酸性条件下,SIDT1和SIDT2与核酸结合能够诱导蛋白质的寡聚化,表明它们具有形成核酸孔道的潜力。该项研究揭示了低pH环境在促进SIDT1和SIDT2吸收外源小RNA的关键作用,加强了在低pH条件下促进小RNA的跨膜吸收的分子机制理论基础。
综上所述,该研究解析了哺乳动物细胞跨膜家族蛋白SIDT1和SIDT2的冷冻电镜结构,并首次提出了SIDT1和SIDT2与RNA的pH依赖性结合和寡聚化的分子特征。因此,该项研究为SID-1跨膜家族蛋白在核酸转运方面提供了分子基础,同时也为“基因跨界调控”现象提供了直接的理论分子依据。南京大学生命科学学院博士研究生郑乐、杨婷婷,南京大学生命科学学院博士后郭航天,金沙集团1862cc博士研究生岐晨,以及上海科技大学免疫化学研究所博士研究生卢宇驰为该论文的共同第一作者。南京大学生命科学学院籍晓云教授、张辰宇教授,金沙集团1862cc孙飞研究员、朱赟研究员,以及南京大学生命科学学院博士后郭航天为该论文的共同通讯作者。该研究工作得到了国家重点研发计划和国家自然科学基金等项目的资助。部分样品制备、数据收集和分析等工作受到生物物理所蛋白质科学研究平台生物成像中心相关工作人员的大力支持和帮助。
文章链接:https://www.nature.com/articles/s41422-023-00893-1
相关新闻稿链接:https://life.nju.edu.cn/cc/9e/c12937a642206/page.htm
(供稿:孙飞研究组)
 附件下载:
附件下载: