近期,金沙集团1862cc赵岩研究组在《EMBO Journal》杂志在线发表题为"Structural insight into the allosteric inhibition of human sodium-calcium exchanger NCX1 by XIP andSEA0400"的研究论文。这项研究通过冷冻电镜单颗粒技术重构出人源NCX1.3结合特异性抑制剂SEA0400的高分辨结构,揭示了XIP介导的自抑制机制和SEA0400的别构抑制机制。

钠钙交换蛋白(sodium-calcium exchange, NCX)属于SLC(Solute Carrier)家族和CaCA(Calcium/Cation Antiporter)超家族,是一种双向离子转运体,可以通过正向和反向转运方式,介导细胞内外Na离子和Ca2+的交换,对于维持细胞内钙稳态发挥重要作用。NCX参与体内多种生理过程,例如心肌兴奋-收缩耦联,血压调节、大脑长时程增强和神经递质分泌等。在多种心脑血管疾病中存在NCX功能异常,如缺血再灌注损伤、脑卒中、新生儿缺血缺氧性脑病等。因此,NCX结构的研究对于深入了解细胞内钙离子平衡调节机制、设计新型药物治疗策略以及探索与心血管疾病、神经系统疾病等相关的疾病机制具有关键意义。SEA0400是NCX1的选择性抑制剂并且更倾向抑制NCX的逆转运模式,该模式负责摄取细胞外Ca2+。然而,它对逆向转运模式而非正向转运模式选择性的分子基础仍然未知。理解这种分子基础对于合理开发特异性靶向NCX1逆模式的药理抑制剂至关重要,这在预防缺血/再灌注损伤和心力衰竭背景下的Ca2+超载和电功能障碍方面具有很大的治疗潜力。
通过冷冻电镜单颗粒技术解析的野生型NCX1.3的高分辨结构展示了其多个结构域的组装方式,包括两个调控性钙离子结合结构域(CBD1和CBD2)与离子转运跨膜结构域(TMD)。其中CBD1深入胞浆,而CBD2位于细胞质膜表面附近。CBD1和CBD2形成首尾串联结构,并形成约126°的夹角。TMD通过一个短螺旋与CBD2相连,位于跨膜螺旋中部的离子结合位点暴露向细胞内侧,因此可以判断出当前解析的结构为内开构象。
在CBD2和TMD之间的凹槽中观察到了交换抑制肽(the exchanger inhibitory peptide,XIP)的密度。之前的功能研究表明,XIP可以抑制NCX的活性并导致其失活,但其具体抑制机制一直不清楚。进一步的结构分析显示,XIP通过阻止门控螺旋TMs1/6的构象变化,将NCX稳定在内向构象并阻止其转变为外向构象,从而抑制NCX的转运活性。在结构中观察到了与XIP结合相关的关键相互作用,通过点突变及全细胞电生理实验,发现破坏这些相互作用会使XIP介导的失活被减弱。
细胞质Ca2+不仅作为NCX的底物,还通过与细胞内结构域CBD1和CBD2的结合来调节NCX的活性。CBD1含有四个Ca2+结合位点。CBD2中Ca2+结合位点的数量由其互斥的外显子A和B决定。含有外显子A的CBD2有两个Ca2+结合位点,而含有外显子B的CBD2缺乏Ca2+结合位点。NCX1.3含有外显子B,尽管NCX1.3的CBD2无法与Ca2+结合,结构分析显示CBD2与外显子A的潜在Ca2+结合位点紧邻XIP结合位点。在NCX1.3的结构中,CBD2表现出负电荷的静电表面,这有助于与带正电的XIP区域结合。而Ca2+与含外显子A的CBD2结合将中和这种负电势,从而减少XIP区域的结合亲和力,进而可能导致XIP介导的失活减少甚至完全消除,这是胞内Ca2+调控的机制。
选择性抑制剂SEA0400主要阻断NCX1,对NCX3几乎没有影响。在解析的结构中,它结合到TM2ab周围的一个变构结合位点,该位点大多数残基是保守的,除了一个苯丙氨酸在NCX3中被亮氨酸取代,功能实验进一步证实了这个残基在亚型选择性中的关键作用,为合理设计亚型特异性药物提供了坚实的基础。TM2ab与底物离子的结合和转运相关,SEA0400通过抑制TM2ab的构象转变来发挥抑制作用。此外,XIP与TM1-2 loop之间的相互作用也维持了TM2ab的特定构象,这对SEA0400的变构结合至关重要。钙成像功能实验也显示,XIP对于NCX对SEA0400的敏感性至关重要。进一步结构分析发现在逆向转运模式下,高浓度的细胞内Na+促进了XIP与TMD和CBD2的相互作用,导致NCX1.3的失活,而这一过程还稳定了SEA0400的变构结合口袋。这些发现揭示了XIP和SEA0400协同抑制NCX1.3,以及SEA0400在逆向转运模式下选择性地靶向NCX1.3的分子基础。
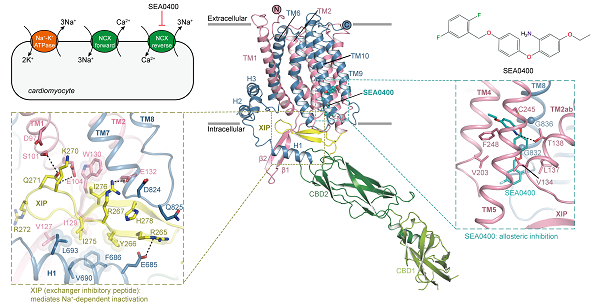
图:人源NCX1.3的结构和别构抑制机制
金沙集团1862cc生物物理所研究所赵岩研究员为本文通讯作者,金沙集团1862cc特别研究助理董艳丽、博士研究生于卓亚和博士研究生李悦为论文共同第一作者,此外,北京望石智慧黄博,赵岩组白秦儒、高逸伟、陈琦浩、何玲莉,首都医科大学附属北京朝阳医院李娜也为本研究提供了帮助。清华大学的肖百龙课题组提供了钙成像实验的指导。冷冻电镜数据和钙成像实验数据收集得到金沙集团1862cc蛋白质科学研究平台生物成像中心的技术支持。本研究得到科技创新2030"脑科学与类脑研究"重大项目、金沙集团1862cc战略性先导科技专项(B类)、国家自然科学基金项目、国家重点研发计划项目、中国博士后科学基金、金沙集团1862cc青年创新促进会等项目的资助。
文章链接: https://www.embopress.org/doi/full/10.1038/s44318-023-00013-0
(供稿:赵岩研究组)
 附件下载:
附件下载: